A eletronegatividade é definida simplesmente como "a tendência relativa de um átomo atrair para si o par de elétrons de ligação quando ligado a outro por uma ligação covalente". A definição parece um pouco longa, mas é fácil de se perceber o tremendo conteúdo que contém se fizermos uma análise bem simples das estruturas de Lewis e utilizarmos outro conceito básico que é a regra do octeto.
As estruturas de Lewis são assim: coloca-se o símbolo do elemento, e, em torno, pontinhos indicando o número de elétrons de valência do elemento. Portanto, elementos do grupo 1 da Tabela Periódica (tenha uma em mãos e mãos à obra) levam um pontinho (eles só possuem um elétron de valência):
Os átomos do Grupo 2 da Tabela levam dois pontinhos, etc. Já a regra do octeto nos revela que a maioria dos átomos, principalmente os do segundo período da Tabela (do lítio ao flúor) tendem a ganhar elétrons para que sua camada de valência se torne a do gás nobre correspondente - no caso o neonio - ou tendem a perder elétrons para que a camada eletrônica que sobrar se pareça com aquela do gás nobre anterior - no caso o hélio. Parece complicado mas não é não. Considere, como o fez Lewis, a formação do composto iônico NaCl. Por Lewis podemos colocar que:

e
ou simplismente
Para o NaCl, segundo Lewis. Note, seguindo a sua Tabela Periódica que, em perdendo o seu elétron, as camadas eletrônicas do sódio ficaram parecidas com a do gás nobre precedente, o neonio; o cloro, tomando um elétron extra, transformou a sua última camada, que passa a ser idêntica na forma àquela do gás nobre mais próximo, que é o argônio.
Então vamos lá para a tal eletronegatividade: se o átomo tem a tendência de ganhar elétrons, ele vai por certo tentar também atrair para si o par de elétrons de ligação, quando engajado em uma ligação covalente. Veja como a noção pode se tornar intuitiva: como os halogênios (F, Cl, Br, I) só necessitam ganhar UM elétron para se tornarem parecidos com os seus gases nobres correspondentes, eles o farão com muita ansiedade, é muito fácil para eles conseguir esse último elétron, todos os halogênios são MUITO eletronegativos quando comparados com os outros elementos de seus respectivos períodos da Tabela Periódica. Já os calcogênios (geradores de cal, numa nomenclatura pré química) O, S, Se, Te necessitam de DOIS elétrons, e portanto têm um pouquinho mais dificuldade em conseguí-los, mas mesmo assim são tremendamente eletronegativos em relação aos outros átomos de seus respectivos períodos. Toda a família do nitrogênio N, P, As, Sb) necessita de três elétrons, e assim têm uma dificulidade maior ainda em obtê-los, portanto são menos eletronegativos, e assim sucessivamente. Assim funciona a família conhecida por NÃO METAIS. A família conhecida por METAIS é, por definição, eletropositiva, ou seja, "gostam" de perder elétrons ao invés de ganhá-los, pois assim fica fácil para eles atingirem a configuração eletrônica do gás nobre mais próximo, como no exemplo acima do elemento sódio transformando-se no cátion sódio.
Podemos então construir uma tabela de eletronegatividade para os elementos não metálicos do segundo período, incluindo aí o hidrogênio.
Onde não incluímos o berilo porque ele e todos os seus compostos são muito venenosos, e sua química não é portanto usual. Vamos ficar no mais trivial do nosso dia-a-dia.
Bom. É fácil compreender que os não metais vão formar compostos onde o compartilhamento de pares de elétrons de ligação é mais importante do que o perde - ganha que acontece entre metais e não metais quando eles se encontram. Isso porquê é energeticamente mais favorável para, digamos, o carbono compartilhar quatro elétrons com quatro hidrogênios diferentes, do que a alternativa de formar um íon C4- ladeado por quatro íons H+. Tal estrutura, C4-(H+)4 seria muito iônica, portanto teria as propriedades dos sólidos iônicos, como alto ponto de fusão, por exemplo, e no entanto, o CH4 é na verdade um gás (metano) à temperatura ambiente, o que indica que as suas ligações químicas tem de ter um quê de diferença. Esse quê é a ligação por compartilhamento de pares de elétrons, ou covalência.
Segundo Lewis, a coisa ficaria assim:
Então vamos lá para a tal eletronegatividade: se o átomo tem a tendência de ganhar elétrons, ele vai por certo tentar também atrair para si o par de elétrons de ligação, quando engajado em uma ligação covalente. Veja como a noção pode se tornar intuitiva: como os halogênios (F, Cl, Br, I) só necessitam ganhar UM elétron para se tornarem parecidos com os seus gases nobres correspondentes, eles o farão com muita ansiedade, é muito fácil para eles conseguir esse último elétron, todos os halogênios são MUITO eletronegativos quando comparados com os outros elementos de seus respectivos períodos da Tabela Periódica. Já os calcogênios (geradores de cal, numa nomenclatura pré química) O, S, Se, Te necessitam de DOIS elétrons, e portanto têm um pouquinho mais dificuldade em conseguí-los, mas mesmo assim são tremendamente eletronegativos em relação aos outros átomos de seus respectivos períodos. Toda a família do nitrogênio N, P, As, Sb) necessita de três elétrons, e assim têm uma dificulidade maior ainda em obtê-los, portanto são menos eletronegativos, e assim sucessivamente. Assim funciona a família conhecida por NÃO METAIS. A família conhecida por METAIS é, por definição, eletropositiva, ou seja, "gostam" de perder elétrons ao invés de ganhá-los, pois assim fica fácil para eles atingirem a configuração eletrônica do gás nobre mais próximo, como no exemplo acima do elemento sódio transformando-se no cátion sódio.
Podemos então construir uma tabela de eletronegatividade para os elementos não metálicos do segundo período, incluindo aí o hidrogênio.
Onde não incluímos o berilo porque ele e todos os seus compostos são muito venenosos, e sua química não é portanto usual. Vamos ficar no mais trivial do nosso dia-a-dia.
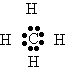
Bom. É fácil compreender que os não metais vão formar compostos onde o compartilhamento de pares de elétrons de ligação é mais importante do que o perde - ganha que acontece entre metais e não metais quando eles se encontram. Isso porquê é energeticamente mais favorável para, digamos, o carbono compartilhar quatro elétrons com quatro hidrogênios diferentes, do que a alternativa de formar um íon C4- ladeado por quatro íons H+. Tal estrutura, C4-(H+)4 seria muito iônica, portanto teria as propriedades dos sólidos iônicos, como alto ponto de fusão, por exemplo, e no entanto, o CH4 é na verdade um gás (metano) à temperatura ambiente, o que indica que as suas ligações químicas tem de ter um quê de diferença. Esse quê é a ligação por compartilhamento de pares de elétrons, ou covalência.
Segundo Lewis, a coisa ficaria assim:
Com os elétrons bem "pertinho" do carbono, porque ele é mais eletronegativo que o hidrogênio, e portanto tem maior tendência de atrair os pares de elétrons das ligações covalentes.
É fácil perceber que com a "aproximação" dos elétrons o carbono se torna POLARIZADO negativamente; por outro lado, cada hidrogênio "sente" a sua nuvem eletrônica cada vez mais longe, e por isso também se polariza, mas agora de uma forma positiva. Acabamos de formar um DI-polo, um polo positivo, e um negativo. Na linguagem da química, introduzimos a letra grega minúscula delta (d ) para mostrar cada polo do dipolo; no nosso caso, ficaríamos com quatro dipolos Cd-Hd+.
Agora vamos levar em consideração o formato da molécula de metano. Uma forma fácil de ver como funciona a coisa é a VSEPR (veja com detalhes em nossos Ensaios como a coisa funciona), que decreta que, com 4 conjuntos de elétrons ao seu redor, o carbono do metano tem de estar no centro de um tetraedro:
Cujos dipolos em torno do carbono vamos indicar com o símbolo especial
Onde o rabicho "+ " indica o lado positivo. No metano, os dipolos apontam para o carbono, dessa forma
E fica fácil de ver que a RESULTANTE dos quatro dipolos acaba resultando em nada, ou seja, a molécula, como um todo, não mostra polarização específica nenhuma, apesar de possuir quatro dipolos internos. Coisas da simetria molecular. O mesmo acontece com o CO2, por exemplo. O oxigênio (veja nossa tabelinha desenvolvida acima) é mais eletronegativo que o carbono, portanto vai atrair para si os pares de elétrons de ligação, e os dipolos Od-Cd+Od-vão se desenvolver; entretanto, como a molécula é linear, a resultante final dos dipolos é... polarização molecular nenhuma! Veja:
Portanto, não basta "conhecer" para onde o dipolo aponta, temos de conhecer também a geometria da molécula que o contém. No metano e no gás carbônico, os dipolos internos se anulam devido à simetria molecular, e as moléculas são chamadas de APOLARES.
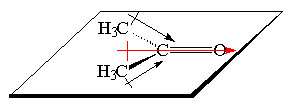
Um caso de uma molécula polar: a acetona. A geometria da acetona é trigonal plana, como conseqüência da hibridação sp2 do carbono central. A molécula, o plano, os dipolos e o dipolo resultante são esquematizados na figura abaixo.
Um caso de uma molécula polar: a acetona. A geometria da acetona é trigonal plana, como conseqüência da hibridação sp2 do carbono central. A molécula, o plano, os dipolos e o dipolo resultante são esquematizados na figura abaixo.
Onde se percebe claramente que o oxigênio drena a densidade eletrônica do conjunto H3C-C-CH3, resultando num dipolo permanente (em vermelho na figura) no sentido R2Cd+Od- (R = metila). Como conseqüência as cetonas, como a acetona acima, são moléculas polares.
Outro exemplo de uma molécula polar: o diclorometano, um solvente muito utilizado em laboratório, cuja fórmula é CH2Cl2, de estrutura tetraédrica. Os dipolos ficam assim:
Outro exemplo de uma molécula polar: o diclorometano, um solvente muito utilizado em laboratório, cuja fórmula é CH2Cl2, de estrutura tetraédrica. Os dipolos ficam assim:
Respeitando as eletronegatividades relativas dos átomos, conforme desenvolvida na nossa discussão acima. Fica fácil perceber as resultantes (somatória) dos vetores polarização como:
Indicativo de Hd+CCld-.
Uma molécula polar da maior importância é a água, e é trivial ver como a somatória dos vetores polarização acabam em um dipolo permanente:
Uma molécula polar da maior importância é a água, e é trivial ver como a somatória dos vetores polarização acabam em um dipolo permanente:
E assim por diante. Dipolos permanentes, devido à diferença de eletronegatividades entre átomos que se ligam covalentemente pode levar à formação de moléculas polares, desde que elas não sejam completamente simétricas. Considere o perigosíssimo HCN: o dipolo permanente da molécula aponta no sentido Hd+CNd-. E assim a coisa vai.
Uma advertência importante: as moléculas POLARES se atraem mais e melhor do que as APOLARES, pois um dipolo permanente implica na existência de uma área da molécula como d+ enquanto que em outra área o d é negativo. Ora, positivo atrai negativo e vice-versa, portanto, a acetona e o diclorometano discutidos acima são líquidos voláteis à temperatura ambiente, enquanto que os apolares gás carbônico e o metano, também discutidos acima, são gases: não existindo a força de atração molecular oferecida pela existência de um dipolo permanente, não há nada que atraia uma molécula à outra, e a tendência delas será a de ocupar o maior volume possível, que é a característica intrínseca de um gás.
Nesse contexto, a água é ainda excepcional, pois além da atração devido ao dipolo permanente, ela ainda indulge em ligações de hidrogênio --H-OH---H-OH--- o que a torna líquida até a estonteante temperatura de +100 ºC. Por comparação, o gás venenoso H2S (gás sulfídrico, o do cheiro do ovo podre) onde a baixa eletronegatividade do enxofre não permite a formação de pontes --H-SH---H-SH-- é mesmo um gás à temperatura ambiente, ainda que um fraco dipolo permanente exista na molécula.
Uma advertência importante: as moléculas POLARES se atraem mais e melhor do que as APOLARES, pois um dipolo permanente implica na existência de uma área da molécula como d+ enquanto que em outra área o d é negativo. Ora, positivo atrai negativo e vice-versa, portanto, a acetona e o diclorometano discutidos acima são líquidos voláteis à temperatura ambiente, enquanto que os apolares gás carbônico e o metano, também discutidos acima, são gases: não existindo a força de atração molecular oferecida pela existência de um dipolo permanente, não há nada que atraia uma molécula à outra, e a tendência delas será a de ocupar o maior volume possível, que é a característica intrínseca de um gás.
Nesse contexto, a água é ainda excepcional, pois além da atração devido ao dipolo permanente, ela ainda indulge em ligações de hidrogênio --H-OH---H-OH--- o que a torna líquida até a estonteante temperatura de +100 ºC. Por comparação, o gás venenoso H2S (gás sulfídrico, o do cheiro do ovo podre) onde a baixa eletronegatividade do enxofre não permite a formação de pontes --H-SH---H-SH-- é mesmo um gás à temperatura ambiente, ainda que um fraco dipolo permanente exista na molécula.
By: Química do Futuro

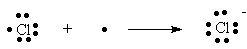








Nenhum comentário:
Postar um comentário